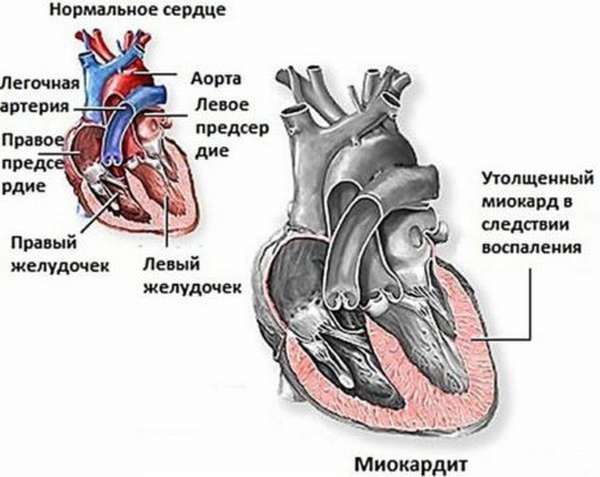
Реперфузионный синдром: причины, симптомы, лечение и профилактика
Содержание:
- Причины реперфузии
- Реперфузионные поврежденияпри остром инфаркте миокарда
- Что означает синдром реперфузии
- Диагностика трепетания желудочков
- Значение ишемических повреждений миокарда. Реперфузионные синдромы
- Ультразвуковое дуплексное сканирование
- Восстановление кровотока конечностей
- Лечение трепетания желудочков
- Причины реперфузии
- Патогенез патологии
- Оглушенный (станнированный) миокард
- «Поздняя» реперфузия
- И.С. Явелов
- Тромбоз
- Значение диагноза «синдром реперфузии», методы борьбы с ним
Причины реперфузии
В критических ситуациях, когда нарушается нормальный кровоток, ткани недополучают кислород, в результате чего развивается гипоксия.
В основе патогенеза синдрома «включения» находится, так называемый, «кислородный парадокс». Его суть заключается в том, что при налаживании нормальной циркуляции крови после временной гипоксии, вызванные недостатком кислорода проявления, не купируются, а, наоборот, проявляются максимально выраженно. В этом и состоит особенность данного феномена. То есть при резкой активизации процессов окисления запускаются механизмы образования большого числа свободных радикалов.
В результате этих процессов нарушается целостность клеточных мембран, что приводит в конечном итоге к массивным разрушениям структуры поврежденных тканей.
Причины снижения проходимости русла сосудов чаще всего обусловлены формированием тромба, появлением на стенках атеросклеротических бляшек, спазме артерии. Все это приводит к нарушениям кровообращения в магистральных сосудах и сосудах головного мозга, что сопровождается характерной для ишемии симптоматикой.
Восстановление кровотока в таких случаях может быть связано со следующими факторами:
- спонтанным расслаблением стенок сосуда;
- введением спазмолитических либо обезболивающих средств;
- растворением тромба ферментативными продуктами;
- удалением кровяного сгустка хирургическим путем;
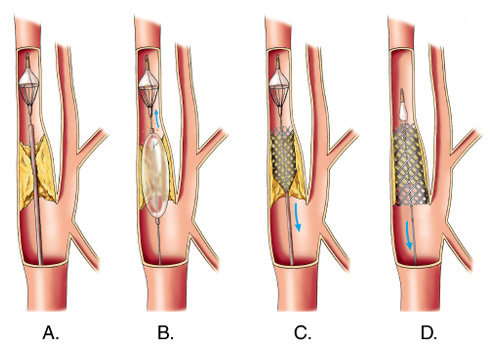
- установкой стента (специального катетера);
- шунтированием просвета сосуда (созданием обходного маршрута для кровотока);
- самопроизвольное восстановление циркуляции крови после оперативного удаления тромба либо при перенаправлении потока крови по альтернативному пути.
Как следствие возобновления кровотока – в тканях головного мозга и сердечной мышцы, возникают отдельные зоны, которые отличаются уровнем физиологической активности и обменных процессов. Причем одна часть таких локальных зон по-прежнему недополучает требуемые объемы крови из-за нарушений проходимости мелких сосудов, а на других участках наблюдается ускоренное разрушение тканей.
Иначе говоря, после возобновления кровообращения клетки тканей просто не способны вследствие предшествующей ишемии усваивать прежние объемы кислорода, жидкости, питательных веществ. По этой причине не происходит выработка энергетического ресурса. В результате нарастает отечность тканей, развиваются воспалительные процессы.
Реперфузионные поврежденияпри остром инфаркте миокарда
Реперфузионные поврежденияпри остром инфаркте миокарда
Резюме. Актуальность проблемы.
Восстановление кровотока в инфаркт-связанной артерии с помощью ангиопластики и стентирования является, в настоящее время, самым эффективным методом лечения острого инфаркта миокарда (ОИМ) и уменьшения зоны некроза. Однако данная тактика имеет неблагоприятные осложнения в виде развития реперфузионного синдрома, который наносит дополнительное повреждение миокарду.
. Цель работы. Представить обзорсовременнойлитературыпопроблемереперфузионного повреждения при остром инфаркте миокарда и раскрыть основные патогенетические механизмы этого вида повреждения.
Ключевые слова: острый инфаркт миокарда, реперфузионное повреждение, кардиопротекция.
Контактное лицо:
Sharafeev A.Z., Bayazitova V.A
Kazan State Medical Academy. 11 Mushtary street, 420012, Kazan, Russia
Reperfusioninjuryinacute myocardial infarction
Abstract. Background. Angioplasty and stenting are the most effective treatment method of acute myocardial infarction (AMI) nowadays, nevertheless coronary reperfusioncomes atapriceandinducesadditionaldamagetothemyocardium– reperfusion injury.
Aim. Review the current literature about the problem of reperfusion injury in patients with acute myocardial infarction and reveal the basic pathogenic mechanisms ischemia/reperfusion injury.
Key words: acute myocardial infarction, reperfusion injury, cardioprotection.
Contact person:
Sharafeev Aydar,
Актуальность проблемы. Быстрое восстановление коронарного кровотока и реперфузия ишемизированного миокарда приводит к уменьшению конечного размера инфаркта и, как следствие, смертности.
Приближение сегмента ST к изолинии после ангиопластики прямо пропорционально улучшению перфузии миокарда и обеспечивает благоприятный исход заболевания .
В мировой кардиологии, широко признано, что время для реперфузии миокарда, подвергающегося ишемии, является ключевым и представляется сильной детерминантой для сохранения миокарда (оглушенного миокарда).
Цель работы: представить обзор современной литературы по проблеме реперфузионного повреждения при остром инфаркте миокарда и раскрыть основные патогенетические механизмы этого вида повреждения.
Материалы и методы. Нами был произведен анализ современной зарубежной и отечественной литературы за последние несколько лет по проблеме реперфузионного сидрома.
Результаты. Классическая догма «время – это мышца» существенно повлияла на лечение пациентов с ОИМ. Исследования Дженнингса и группы Реймера в начале 1980-х годов показали, что ранняя реперфузия может спасти ишемизированный миокард. Также они выявили, что эффективность реперфузии в основном зависит от тяжести и продолжительности предшествующей ишемии .
В этом смысле, реперфузионное повреждение может рассматриваться как неизбежный вред, связанный с процессом восстановления кровотока в ишемизированном миокарде.
Реперфузионное повреждение может быть определено как повреждение, вызванное восстановлением кровотока после ишемического эпизода,ведущего к гибели только тех клеток,которые были обратимо повреждены к моменту восстановления кровотока.
Реальное воздействие ишемического реперфузионного повреждения на окончательный размер инфаркта миокарда не было четко определено, в основном, потому что это также зависит от длительности ишемии. В исследованиях на животных, этот показатель может достигать значения до 30-40% от исходного размера очага некроза миоцитов .
Реперфузионное повреждение возникает в течение нескольких минут после восстановления тканевой перфузии и вызывает гибель жизнеспособных кардиомиоцитов. Гибель их происходит в трех формах: некроз, апоптоз и аутофагия; все они взаимосвязаны, но только апоптоз тщательно регулируется.
Первой патологической особенностью, связанной с реперфузионным повреждением, является гиперконтрактура миоцитов с формированием полос сокращения по всей длине миокарда, что приводит к возникновению реперфузионных аритмий.
Основной механизм гиперконтрактуры во время реперфузии полностью не выяснен, но известно, что перегрузка ионов Ca2+ играет решающую роль в данном процессе. Гомеостаз Ca2+ в «здоровых» миоцитах нарушается при ишемическом/ реперфузионном повреждении . Степень перегрузки ионами кальция во многом управляется нарушением обмена веществ, вызванного ишемией.
Что означает синдром реперфузии
В том случае, если недостаток питания был кратковременным (до 3 часов) или частичным, то после появления кровообращения происходит достаточно быстрая нормализация обменных процессов.
При длительной ишемии поступление кислорода, микроэлементов, глюкозы и жидкости запускает цепь реакций, они расширяют зону повреждения сердечной мышцы или головного мозга. Это проявляется в виде реперфузионного синдрома.
Его суть состоит в том, что в период ишемии в клетках и внеклеточном пространстве скопились продукты нарушенного обмена веществ, биологически активные соединения, которые сужают сосуды. При нормализации кровообращения они переносятся в соседние участники сердца или мозга, вызывая их разрушение.
Клиническими проявлениями синдрома реперфузии являются:
- при инфаркте – нарушения ритма, прогрессирование сердечной недостаточности, появление или возобновление боли, отсутствие улучшения ЭКГ, ЭхоКГ, расширение сердца, формирование аневризмы, падение давления, обморочные состояния;
- при ишемическом инсульте – изменение сознания, нарушение рефлексов, углубление двигательных расстройств, ухудшение речи, появление признаков отека мозга, мозговой комы, судорожного синдрома, повышение температуры тела, переход ишемии в кровоизлияние, замедление восстановления, несмотря на интенсивную терапию.
А здесь подробнее о сцинтиграфии миокарда.
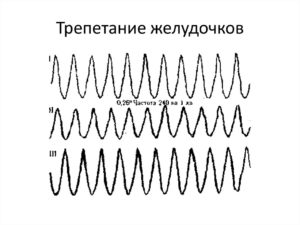
Диагностика трепетания желудочков
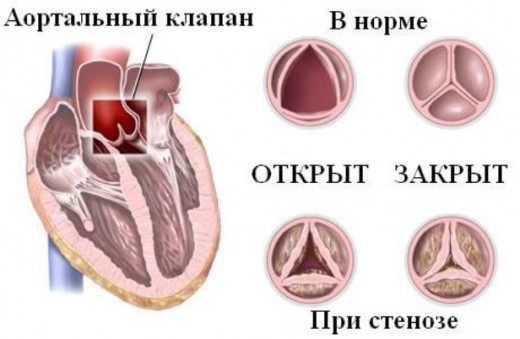
Распознать трепетание и мерцание желудочков позволяют клинические и электрокардиографические данные. ЭКГ-картина при трепетании желудочков характеризуется регулярными, ритмическими волнами практически одинаковой амплитуды и формы, напоминающими синусоидную кривую с частотой 200—300 в мин.; отсутствием изоэлектрической линии между волнами; отсутствием зубцов Р и Т.
В случае фибрилляция желудочков регистрируются непрерывно меняющие форму, длительность, высоту и направление волны с частотой 300-400 в мин., отсутствие изоэлектрической линии между ними. Трепетание и мерцание желудочков следует дифференцировать от массивной ТЭЛА, тампонады сердца, пароксизмальной желудочковой тахикардии и наджелудочковых аритмий.
Значение ишемических повреждений миокарда. Реперфузионные синдромы
Ишемические повреждения миокарда имеет большое прогностическое значение. Поврежденный миокард является зоной риска развития некротических и рубцовых изменений, тяжелых аритмий, недостаточности кровообращения. Падение основных функциональных характеристик обусловлено ухудшением питания миокарда. Одновременно в связи с понижением эффективности симпатической стимуляции сердца падает толерантность к физическим нагрузкам. Тяжесть ИПМ связана с площадью повреждения, которую обозначают как «зону риска».Длительная ишемия миокарда встречается в двух разновидностях: при развитии реперфузионного синдрома и при острых формах ИБС (нестабильной стенокардии).
Наиболее полные представления об ишемическом поражении миокарда получены в результате экспериментальных и хирургических исследований по реперфузии миокарда в ближайшие 15—30 минут от начала ишемического эпизода (приступа стенокардии) или временного пережатия коронарной артерии в эксперименте.
Эти исследования позволили развить новую концепцию ишемии. Если раньше считалось, что длительная ишемия неизбежно вызывает некроз миокарда, то теперь доказано , что имеется гораздо более длительный срок переживания миокарда в условиях критически низкого кровообращения.
Результаты вмешательств, восстанавливающих кровоток в коронарной артерии через 30 и даже 60 минут после начала окклюзии сосуда, позволили установить: 1) если восстановление кровотока достаточно полное, то инфаркт миокарда или не развивается, или резко сокращается в размерах; 2) функции миокарда также полностью восстанавливаются; 3) функциональное восстановление миокарда часто запаздывает сравнительно с восстановлением кровообращения.
Однако энтузиазм клиницистов после первых вмешательств в дальнейшем несколько снизился, У части больных вслед за эффективной реперфузией состояние сердца ухудшалось. Появились данные о травмирующем миокард действии реперфузии. Ухудшение выражалось в развитии аритмий, иногда тяжелых, недостаточности сердца, повторных ишемических эпизодов. Эти явления обозначены как «реперфузионный синдром». Он зависит не только от глубины ишемического поражения миокарда, но и от длительности периода предреперфузионной ишемии.
Сущность реперфузионного синдрома связана с тем, что быстрое восстановление кровотока приводит к вымыванию продуктов ишемического повреждения из резко поврежденных миоцитов, которые погибают от перегрузки кислородом и быстрого прироста свободных кислородных радикалов. Гибель поврежденных клеток ведет к скоплению перекисных соединений липидов, перегрузке менее поврежденных клеток кальцием.
Скопившиеся в месте повреждения лейкоциты через сдвиги в обмене арахидоновой кислоты и выделение лейкотриенов играют особую роль при реперфузии, повышая число погибших клеток и вызывая вазоконстрикторные воздействия на микрососуды и неблагоприятно влияя на сохранившиеся миоциты. Большая перегрузка кальцием и выход калия из поврежденных клеток вызывает электрическую нестабильность сердца. Эти механизмы подтверждены положительным действием для профилактики и лечения реперфузионного синдрома антагонистов кальция, «скавендеров» свободных радикалов (каталазы, дисмутазы и др.), ингибицией местной воспалительной реакции (кортикостероиды).
Понятно, что реперфузионные изменения моделируют то, что происходит при нестабильной стенокардии, когда периодически в достаточно длительные отрезки времени (10—15 минут) происходит резкое ухудшение, а затем спонтанное восстановление коронарного кровотока.
— Также рекомендуем «Формы ишемии миокарда. Обратимость ишемических повреждений миокарда»
Ультразвуковое дуплексное сканирование
Ультразвуковое дуплексное сканирование позволяет определить проходимость артерий, локализовать место закупорки сосуда и состояние кровотока ниже места окклюзии. Нередко при острой ишемии этой диагностики бывает достаточно, чтобы определить лечебную тактику и отправить пациента на операционный стол. При эмболии или разрыве артерии ниже места закупорки обычно пустые или тромбированные, кровоток в них не определяется. Кровоток в венах резко замедлен. При тромбозе можно обнаружить кровоток ниже места закупорки, однако скорость его резко снижена, чаще всего по магистральным сосудам кровотока не определятся, а по коллатералям можно увидеть движение крови. Как правило, это связано с тем
Восстановление кровотока конечностей
Реперфузионный синдром в этом случае обычно тоже сопровождается яркой симптоматикой. Особенно остро эти явления дают о себе знать через сутки после начатого лечения.
Если обобщить вышеизложенную информацию, можно заключить, что период возобновления кровообращения на участке с сильным поражением тканей обычно сопровождается, как местными, так и общими нарушениями. Например, при реперфузии мозга нарастает отек тканей, а после операции на нижней конечности увеличивается интенсивность болей, и наблюдаются трофические расстройства.
Иначе говоря, синдром реперфузии развивается там, где произошел эпизод ишемии. Причем чем больше площадь поражения и продолжительней период нарушения кровотока, тем ярче будет выражена клиническая симптоматика.
Из системных проявлений синдрома «включения» особое внимание следует уделить развитию полиорганной недостаточности — это тяжелейшая тяжелая реакция организма. В большинстве клинических случаев наблюдается нарастание симптоматики ОРДС (респираторного дистресс — синдрома), энцефалопатии
Лечение трепетания желудочков
При развитии трепетания или фибрилляции желудочков необходимо немедленное оказание реанимационной помощи, направленной на восстановление синусового ритма. Первичная реанимация может включать нанесение прекардиального удара или выполнение искусственного дыхания и непрямого массажа сердца. Основными компонентами специализированной сердечно-легочной реанимации являются проведение электрической дефибрилляции сердца и ИВЛ.
Одновременно с реанимационными мероприятиями производится внутривенное введение растворов адреналина, атропина, гидрокарбоната натрия, лидокаина, прокаинамида, амиодарона, магния сульфата. Наряду с этим производят повторную электрическую дефибрилляцию с увеличением энергии после каждой серии разрядов (от 200 до 400 Дж). При рецидивах трепетания и фибрилляции желудочков, обусловленных полной атриовентрикулярной блокадой сердца, прибегают к временной эндокардиальной стимуляции желудочков с частотой ритма, превышающей их собственную частоту.
Реанимационные мероприятия прекращаются в том случае, если в течение 30 минут у больного не восстанавливается спонтанное дыхание, сердечная деятельность, сознание, отсутствует реакция зрачков на свет. После успешно проведенной реанимации для дальнейшего наблюдения пациента переводят в ОРИТ. В дальнейшем лечащим кардиологом принимается решение о необходимости имплантации двухкамерного кардиостимулятора или кардиовертер-дефибриллятора.
Причины реперфузии
Патогенетической основой реперфузионного синдрома является так называемый «кислородный парадокс». Сущность феномена состоит в следующем. Если сердце перфузировать раствором, который не содержит кислород (или содержит его мало), а через 40 мин и более перейти на перфузию раствором с нормальным напряжением O2, то в результате такой перфузии нарушения, обусловленные предыдущей гипоксией, не только не уменьшаются, как этого следовало бы ожидать, а становятся более выраженными (парадокс!).
Основу указанного парадокса составляет резкая активация процессов пероксидного окисления липидов, обусловленная поступлением кислорода в клетки, в которых содержится большое количество восстановленных компонентов дыхательной цепи. Происходит сбрасывание электронов в обход дыхательной цепи непосредственно на молекулы кислорода, вследствие чего образуется большое количество свободных радикалов. Последние инициируют реакции пероксидного окисления липидов, являющиеся важным молекулярным механизмом повреждения клеточных мембран.
Под определением реперфузионного синдрома понимают состояние, которое наступает после возобновления нормальной циркуляции крови на пораженном ишемией участке. Медикам часто приходится на практике сталкиваться со всевозможными проявлениями ишемии. Снижение кровотока может быть обусловлено разными причинами.
Такое нарушение бывает кратковременным или длительным, оно может охватывать небольшой участок либо поражать значительную часть тела. От этого фактора зависит, насколько успешно будет проходить восстановление.
В принципе, реперфузионный синдром можно считать своеобразным ответом организма на ишемию любой природы происхождения. В медицинских кругах подобное состояние еще называют «включением». Тем не менее, понятие о реперфузионном кардиальном синдроме должны знать и сами пациенты. Для этого и была подготовлена статья.
В основе патогенеза синдрома «включения» находится, так называемый, «кислородный парадокс». Его суть заключается в том, что при налаживании нормальной циркуляции крови после временной гипоксии, вызванные недостатком кислорода проявления, не купируются, а, наоборот, проявляются максимально выраженно.
В результате этих процессов нарушается целостность клеточных мембран, что приводит в конечном итоге к массивным разрушениям структуры поврежденных тканей.
Причины снижения проходимости русла сосудов чаще всего обусловлены формированием тромба, появлением на стенках атеросклеротических бляшек, спазме артерии. Все это приводит к нарушениям кровообращения в магистральных сосудах и сосудах головного мозга, что сопровождается характерной для ишемии симптоматикой.
Восстановление кровотока в таких случаях может быть связано со следующими факторами:
- спонтанным расслаблением стенок сосуда;
- введением спазмолитических либо обезболивающих средств;
- растворением тромба ферментативными продуктами;
- удалением кровяного сгустка хирургическим путем;
- установкой стента (специального катетера);
- шунтированием просвета сосуда (созданием обходного маршрута для кровотока);
- самопроизвольное восстановление циркуляции крови после оперативного удаления тромба либо при перенаправлении потока крови по альтернативному пути.
Иначе говоря, после возобновления кровообращения клетки тканей просто не способны вследствие предшествующей ишемии усваивать прежние объемы кислорода, жидкости, питательных веществ. По этой причине не происходит выработка энергетического ресурса. В результате нарастает отечность тканей, развиваются воспалительные процессы.
Патогенез патологии
Несмотря на то, что в основе ишемии тканей лежит недостаток кислорода и веществ для образования энергии в клетках, а реперфузия связана с активизацией их поступления, в результате и тот, и другой процесс приводят к разрушению клеток. Более того, реперфузия способна оказывать непосредственное повреждение, а также усиливать и распространять проявления ишемии.
При возобновлении кровотока отмечается интенсивное поступление кислорода, солей натрия, кальция, жидкости и глюкозы к клеткам, которые из-за предшествующей ишемии потеряли способность их усваивать. Поэтому энергия не образуется, или ее продукция крайне низкая.
Мембраны этих клеток не могут сдерживать поток воды и солей натрия, что приводит вместо восстановления возбудимости и активности к резкому их угнетению, нарастанию отечности тканей. Избыток кальция вызывает ускоренное образование соединений, провоцирующих воспалительную реакцию.
Важной причиной развития реперфузионного синдрома является активизация свободнорадикального окисления. В этом участвуют соли кальция, а также поврежденные клеточные элементы – митохондрии, из которых происходит «утечка» электронов. Свой вклад вносит и поступление гормонов надпочечников, простагландинов, микротромбоз сосудов скоплениями тромбоцитов
Свой вклад вносит и поступление гормонов надпочечников, простагландинов, микротромбоз сосудов скоплениями тромбоцитов.
Смотрите на видео о реперфузии и методах лечения:
Оглушенный (станнированный) миокард
Станнирование относится к состояниям, при которых выявляется стойкая систолическая дисфункция левого желудочка в отсутствие необратимого повреждения миокарда после реперфузии. Эти состояния обозначаются термином «жизнеспособный дисфункционирующий миокард».
Феномен оглушенного (станнированного) миокарда проявляется обратимым угнетением сократимости миокарда, сохранившего жизнеспособность после реперфузии. Станнирование миокарда является осложнением реперфузии и является одной из форм реперфузионного повреждения миокарда.
Выраженность сократительной дисфункции после реперфузии зависит от целого ряда факторов:
-
продолжительности ишемического периода,
-
тяжести ишемии (полная или неполная),
-
степени восстановления кровотока после проведения соответствующих лечебных мероприятий
-
скорости восстановления коронарной перфузии,
-
объема ишемизированного миокарда
-
выраженности нагрузки на сердце.
Важным признаком оглушенного миокарда является наличие несоответствия между кровотоком и функцией миокарда: в то время как коронарный кровоток полностью или почти полностью восстановлен, сохраняются нарушения сократительной функции миокарда.
«Поздняя» реперфузия
здесь
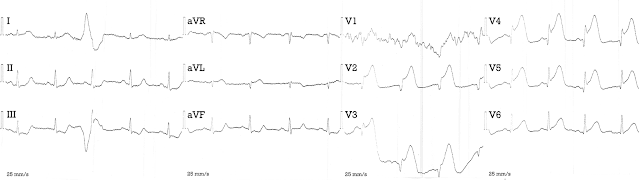 Первая ЭКГ пациентки, записанная в ЦРБ (t=3 ч 10 мин)
Первая ЭКГ пациентки, записанная в ЦРБ (t=3 ч 10 мин)
- Элевация ST V2-V6 до 5 мм (в V4) и aVL
- Низкая амплитуда QRS в грудных отведениях, особенно V2-V4
- Патологический Q V2-V6, aVL максимально в V2
- Реципрокная депрессия ST II, III, aVF
острейшему передне-боковому ИМпST
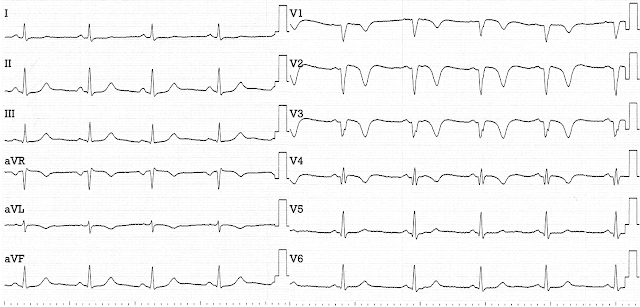
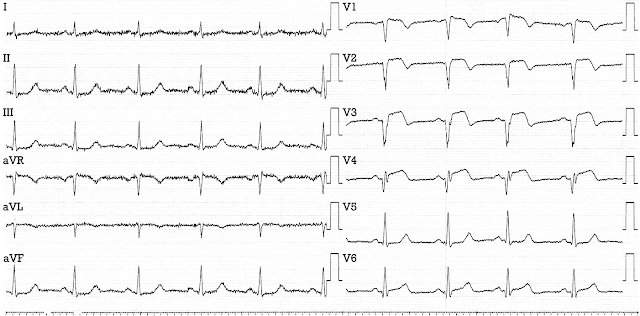 1-я ЭКГ в клинике (t=4 ч 00 мин)
1-я ЭКГ в клинике (t=4 ч 00 мин)
- Глубокие Q V2-V4 (фактически QS)
- Элевация ST сохраняется, хотя и заметно меньшая по выраженности
- Острейшего Т нет и в помине, а в V4 появился S
- Значительно меньше выражена реципрокность во II, III, aVF
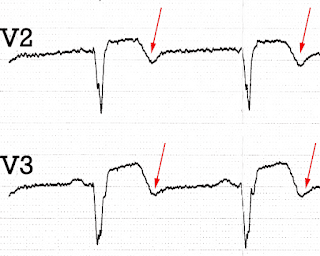 Увеличенные V2-V3. Терминальная инверсия Т. Репефузия
Увеличенные V2-V3. Терминальная инверсия Т. Репефузия
Первые лабораторные данные (t около 5 часов):
 ЭКГ через 4 часа (t= 7 часов 30 мин).
ЭКГ через 4 часа (t= 7 часов 30 мин).
- Полное разрешение элевации ST в прекардиальных отведениях
- Сформировавшийся патологический Q (QS)
- Глубокий Т реперфузии в V1-V4, в V5-V6 вообще близкие к нормальным зубцы Т!
- Реципрокность полностью разрешилась.
УЗИ сердца
Наталья Кривенок: парастернального доступадискинезгипокинезапикального доступадискинез апикальных бокового и перегородочного сегментов единым массивом.динамической аневризмы левого желудочка
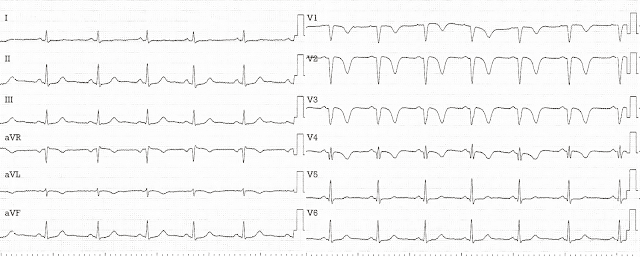 ЭКГ (t=12 час 40 мин)
ЭКГ (t=12 час 40 мин)
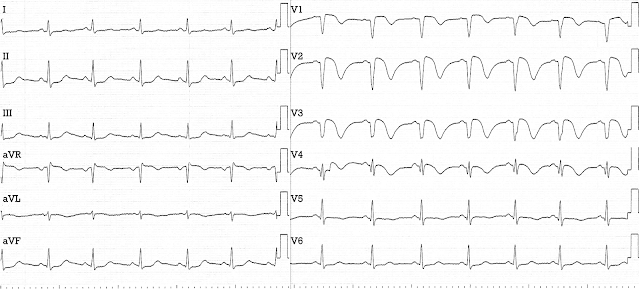 ЭКГ на следующий день (t=32 часа)
ЭКГ на следующий день (t=32 часа)
Резюме:
- Осматривая больных с Инфарктом, я отчетливо осознаю, что лечение инфаркта все равно дает инфаркт на выходе! Чудес не бывает!
- Если имеется элевация ST и начал формироваться Q, то что бы мы не делали, развитие трансмуральных некрозов практически неизбежно. Мы всегда позади инфаркта!
- Даже небольшая, по меркам многих, продолжительность окклюзии коронарной артерии с полной последующей реперфузией способна привести к катастрофически большим инфарктам.
- Большинство инфарктов подвергаются спонтанной реперфузии в течение первых 2-3 суток. Но для миокарда это уже никакой роли не играет. Для инфаркта не бывает «слишком рано», бывает лишь «слишком поздно».
И.С. Явелов
НИИ физико-химической медицины ФМБА России, МоскваСкорейшее восстановление кровотока – наиболее действенный способ лечения острого коронарного синдрома со стойкими подъемами сегмента ST на ЭКГ. При этом вне зависимости от способа, которым оно осуществляется, критически важным является время, прошедшее после начала симптомов. В статье приводятся и анализируются результаты исследования STREAM – наиболее крупного проспективного контролируемого клинического исследования по сопоставлению фармако-инвазивного подхода и первичного ЧКВ в ранние сроки ОКС со стойкими подъемами сегмента ST.
Ключевые слова: острый коронарный синдром, стойкий подъем сегмента ST, фибринолитики, чрескожное коронарное вмешательство.
Сведения об авторе:
Явелов Игорь Семенович – д.м.н., профессор, НИИ физико-химической медицины ФМБА России
Тромбоз
Тромбоз —это процесс прижизненного образования на внутренней оболочке сосудов конгломератов, состоящих из ФЭК. Эти конгломераты называются тромбами. В некоторых случаях тромбоз выступает как компенсаторно-приспособительный процесс, который направлен на остановку кровотечения при повреждении или разрыве сосуда.
| МЕСТНЫЕ | ОБЩИЕ |
| 1. Повреждение целостности сосудистой стенки. | 1. Изменение реологических свойств крови. |
| 2. Замедление кровотока. | 2. Дисбаланс между свертывающей и противосвертывающей системами крови. |
| (пол, возраст, климатические условия проживания, конституция; характер имеющихся заболеваний, травмы, проведенные операции). |
В процессе тромбообразования выделяют две фазы: клеточную (адгезия, агрегация и аглютинация тромбоцитов) и плазматическую – фазу свертывания (коагуляция).
1. Клеточная фаза: понижается электрический заряд тромбоцитов и других клеток крови, изменяется электрический потенциал сосудистой стенки при уменьшении содержания АТФ и увеличения АДФ в поврежденных участках сосудов и тромбоцитах, повышения адгезивно-агрегационной способности тромбоцитов и торможения антиагрегационных свойств сосудистой ткани при повреждении эндотелия (обнажается субэндотелиальный слой, где находятся адгезивные белки).
2. Плазматическая фаза (коагуляция): тромбоцитарные факторы свертывания крови поступают в плазму, образуется активный фермент тромбопластин, который способствует превращению неактивного протромбина в тромбин, катализирующий образование фибрина из фибриногена плазмы крови, происходит свертывание крови. Фибрин представляет собой основную массу тромба.
Механизмы тромбоза будут определяться взаимоотношением свертывающей и противосвертывающей систем. Причиной тромбоза является депрессия или дисфункция противосвертывающей системы, на фоне которой провокация тромбинообразования при наличии предрасполагающих факторов и необходимых условий начинает каскад биохимический реакций, заканчивающихся локальным или распространенным внутрисосудистым свертыванием крови с последующим образованием тромба.
Значение диагноза «синдром реперфузии», методы борьбы с ним

Длительный недостаток питания клеток при инфаркте миокарда и инсульте приводит к ишемии тканей.
Он может усугубить тяжесть состояния больного из-за развития реперфузионного синдрома. Для его лечения нужна комплексная медикаментозная терапия.
Причины реперфузии коронарной, головного мозга, ишемии при инсульте
При формировании атеросклеротической бляшки и тромба на ее поверхности, спазме артерии возникает острое нарушение коронарного или мозгового кровообращения. Это проявляется ишемическими нарушениями в тканях. Возобновление кровотока бывает связано с такими факторами:
- расслабление сосуда спонтанное или при введении вазодилататоров (нитратов, спазмолитиков), обезболивающих;
- растворение тромба при помощи ферментов;
- хирургическое удаление кровяного сгустка;
- введение катетера с баллончиком на конце и установка стента (стентирование);
- прокладывание обходного пути кровотока – шунтирование сосудов;
- самостоятельное возобновление кровотока при реканализации тромба, раскрытии коллатеральных (обходных) путей.
В результате в миокарде и тканях головного мозга образуются зоны, в которых клетки имеют неодинаковый уровень обменных процессов, возбудимости и физиологической активности. Часть из тканей не получает крови из-за препятствий на уровне мелких капилляров, артериол (спазм, микротромбоз), в других идет ускоренное разрушение из-за тяжелой ишемии до реперфузии.
https://youtube.com/watch?v=IUrvNv3H89M
В некоторых областях миокарда отмечается обратимая дисфункция – оглушение, гибернация, «спящие клетки».
Патогенез патологии
Несмотря на то, что в основе ишемии тканей лежит недостаток кислорода и веществ для образования энергии в клетках, а реперфузия связана с активизацией их поступления, в результате и тот, и другой процесс приводят к разрушению клеток. Более того, реперфузия способна оказывать непосредственное повреждение, а также усиливать и распространять проявления ишемии.
При возобновлении кровотока отмечается интенсивное поступление кислорода, солей натрия, кальция, жидкости и глюкозы к клеткам, которые из-за предшествующей ишемии потеряли способность их усваивать. Поэтому энергия не образуется, или ее продукция крайне низкая.
Мембраны этих клеток не могут сдерживать поток воды и солей натрия, что приводит вместо восстановления возбудимости и активности к резкому их угнетению, нарастанию отечности тканей. Избыток кальция вызывает ускоренное образование соединений, провоцирующих воспалительную реакцию.
Важной причиной развития реперфузионного синдрома является активизация свободнорадикального окисления. В этом участвуют соли кальция, а также поврежденные клеточные элементы – митохондрии, из которых происходит «утечка» электронов
Свой вклад вносит и поступление гормонов надпочечников, простагландинов, микротромбоз сосудов скоплениями тромбоцитов.
Смотрите на видео о реперфузии и методах лечения: