Принцип работы аппарата искусственного кровообращения
Содержание:
- Подключение ЭКМО (способы канюляции)
- Что такое синдром пересаженного сердца
- Из чего состоит АИК?
- Подключение АИК
- Транспортная упаковка
- Описание изделия
- Составы кардиоплегических растворов
- Определение «Искусственного кровообращения аппарат» по БСЭ:
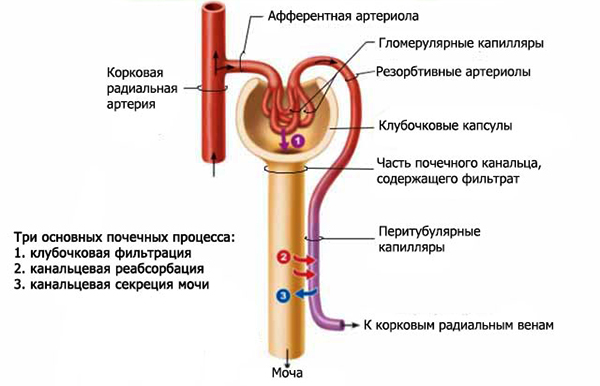
- Оксигенатор
- Патологические процессы
- Искусственное сердце (ИС) и системы вспомогательного кровообращения
- Венозные канюли
- Примечания[править]
- Проведение искусственного кровообращения
Подключение ЭКМО (способы канюляции)
| плюсы | минусы | |
|---|---|---|
| Вено-венозное ЭКМО | • Возмжность избежать артериальной канюляции • Обеспечивает прямую легочную оксигенацию • Улучшает коронарную оксигенацию • Уменьшает риск неврологических нарушений • Поддерживает сердечный выброс • Можно исползовать вазопресоры | • Может иметь место неадекватная доставка кислорода • Не обеспечивает прямой поддержки сердца • Высокий риск рециркуляции |
| Вено-артериальное ЭКМО | • Обеспечивает сердечно-легочную поддержку • Уменьшает преднагрузку правого желудочка • Нет риска рециркуляции крови • Лучшая доставка кислорода | • Увеличивает постнагрузку левого желудочка • Снижает пульсовое давление • Коронарная оксигенация кровью из левого желудочка • «Оглушенный миокард» • Влияет на церебральную ауторегуляцию (ухудшает миогенные реакции церебральных артерий и вызывает нарушения эндотелиальной функции). |
Что такое синдром пересаженного сердца
Несмотря на то, что после пересадки механического аналога сердца или замены его клапанов появляется шанс на жизнь, многие пациенты не ощущают облегчения. Это связано с такими причинами:
- возникает страх поломки устройства,
- шум от работы по ночам не дает возможности уснуть,
- больной постоянно фиксирован на ритме сердцебиений,
- нарастает депрессия и суицидальные наклонности.
Появляются жалобы на головную боль, онемение конечностей, обмороки и головокружения, сильную утомляемость. Это заставляет больных резко ограничивать физическую активность.
Одним из опасений является отсутствие боли при нарушении работы прибора, поэтому пациенты боятся утратить контроль за своим здоровьем. Подобная симптоматика лечится совместными усилиями кардиолога и психиатра.
Из чего состоит АИК?
Искусственное кровообращение, обеспечиваемое аппаратом, временно выполняет работу легочной системы и сердца пациента. Поэтому устройство состоит из нескольких узлов. Рассмотрим каждый из них.
 АИК в кардиохирургии
АИК в кардиохирургии
Оксигенератор
Кровь в оксигенератор направляется самопроизвольно из катетеризированных артерий. В данном отделе происходит ее насыщение кислородом, освобождение от углекислоты. Существуют оксигенераторы, в которых кровь имеет прямой контакт с кислородом (пленочные или пузырьковые разновидности), а в остальных генераторах она обогащается кислородом в процессе перфузии через специальную мембрану.
Артериальный насос
Устройство конструктивно делится на разновидности:
- камерный насос;
- мембранный насос;
- роликовый насос;
- пальчиковый насос.
Коронарный отсос
Цель данного компонента аппарата – отсасывание избыточной крови из места повреждения и возвращение ее в циркуляционный контур системы, поддерживающей искусственное кровообращение при операции.
Теплообменник
Устройство предназначено для охлаждения или согревания крови до положенной температуры. Так появляется возможность не допустить повреждения клеток крови в процессе перфузии. Теплообменник необходим при долговременных операциях, когда кровь проходит многократно через циркуляционный контур. В сложных случаях применяется гипотермия. Теплообменники бывают щелевыми и трубчатыми.
Фильтр-ловушка
Кровь, которая попадает в систему, обеспечивающую искусственное кровообращение, имеет свойство формировать сгустки, газовые пузырьки, поэтому перед тем, как она снова поступит в кровеносный цикл пациента, ее нужно отфильтровать.
Подключение АИК
Схема и техника подключения АИК могут быть различными в зависимости от операционного доступа и вида патологии сердца (или сосуда). Для нагнетания крови чаще используют одну из бедренных или подвздошных артерий, откуда ретроградно кровь поступает в брюшную и грудную аорту, затем в её дугу, проходя в сосуды, питающие мозг и сердце (коронарные сосуды). Иногда артериализированную кровь нагнетают через канюлю в восходящий отдел аорты. Дренирование венозной системы производят либо с помощью двух пластмассовых катетеров, введённых в обе полые вены через правое предсердие либо с помощью одного катетера, введённого в правое предсердие или желудочек. Венозная кровь поступает в оксигенатор АИК, где насыщается кислородом, и насосом АИК направляется в артериальную систему больного. Обе эти манипуляции производят после введения в кровь больного гепарина в дозе 2—3 мг на 1 кг веса тела. Для большей безопасности больного канюлирование артериальной системы должно предшествовать катетеризации венозного русла.
Транспортная упаковка
Комплект оборудования АВК-Н представлен на фотографии.
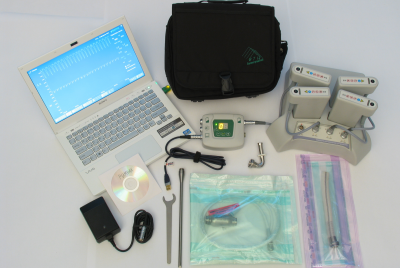
Для транспортировки АВК-Н используется кейс из сополимерного полипропилена. Корпус герметичный, характеризуется высокой стойкостью к ударным нагрузкам. В конструкцию встроен атмосферный клапан для выравнивания давления,5 замков ABS. Размер кейса 79.50×51.80×31.00 см, вес около 25 кг.
Для удобства перемещения системы в кейс встроены колеса и выдвижная ручка. Кейс состоит из трех уровней. Ложементы каждого уровня спроектированы с учётом удобства размещения всех компонент системы по назначению.

На первом уровне размещаются имплантируемые компоненты АВК-Н, на втором и третьем — экстракорпоральные. Первый и второй уровни объединены в один бокс и содержат полный комплект оборудования, необходимый для проведения операции. Третий уровень содержит оборудование передаваемое пациенту для обслуживания АВК-Н.В крышку кейса встроен органайзер с тремя карманами для размещения сумки пациента и комплекта эксплуатационной документации.
Описание изделия
Быстрый, интуитивно понятный доступ к информации через экран центрального монитора управления (ЦМУ):Графический интерфейс ЦМУ обеспечивает централизованное отображение сообщений в интуитивной понятной форме и с использованием цветных значков. Реакция на сообщения, касающиеся предупреждений и тревог, осуществляется в одно или два касания экрана.• Резервные элементы управления: Управление роликовыми насосами и электронным смесителем газов осуществляется как на панелях самих устройств, так и через ЦМУ, что обеспечивает дублирование системы и разные способы регулировки скорости.• Регулировка окклюзии «на лету»: Механизм окклюзии роликового насоса «по щелчку» дает возможность регулировки на работающем насосе. Чтобы отрегулировать настройку окклюзии, останавливать роликовый насос не нужно.• Самонастраивающиеся зажимы магистралей в роликовом насосе устраняют необходимость использования сменных вставок.• Увеличенное время работы от батареи: Система обеспечивает работу в течение, как минимум, 60 минут от внутренней резервной батареи. Число оставшихся минут четко отображается на значке батареи на экране ЦМУ, предоставляя важную информацию пользователям.• Однонаправленный ручной привод для насоса обеспечивает вращение рукоятки и поток только в правильном направлении.Система поддерживает до 8 насосов, включая 2 центрифужных насоса.• Роликовые насосы с вращающейся головкой, монтируемые на базе или стойках, помогают уменьшить длину контура и гемодилюцию.• Доступны роликовые насосы с диаметром головки 6 или 4 дюймов для различных протоколов перфузии.• Центрифужными и роликовыми насосами можно управлять как с помощью ручки управления скоростью на передней панели насоса, так и через ЦМУ.• Быстрое начало работы роликовых и центрифужных насосов после включения питания дает пользователям возможность Разработан, чтобы помочьклиницистам достигать наилучших результатов.Система искусственного кровообращения Terumo Advanced Perfusion System 1 немедленно реагировать в экстренных ситуациях.• Механизм окклюзии роликового насоса «по щелчку» дает возможность регулировки на работающем насосе.• На артериальном насосе отображаются сообщения, касающиеся предупреждений и тревог, важные для продолжения работы. Рабочий статус насоса и сообщения, касающиеся безопасности, отображаются как на экране самого насоса, так и на ЦМУ.• Самонастраивающиеся зажимы магистралей в роликовом насосе устраняют необходимость использования и замены сменных вставок.• Расположение мотора центрифужного насоса на выносной штанге помогает уменьшить длину магистралей.• Неинвазивный датчик скорости потока устраняет необходимость использования одноразовых датчиков скорости потока.• Однонаправленный ручной привод для насоса обеспечивает вращение рукоятки и поток только в правильном направлении.• Обновленное программное обеспечение роликовых насосов улучшило их рабочие характеристики.• Благодаря новому дизайну защитной крышки роликового насоса улучшен доступ к каналам для магистралей. Металлическое крепление крышки насоса прочное и долговечное.• Новые цветные колпачки для роликовых насосов содержат графические символы, что делает работу интуитивно более понятной и помогает пользователям в изменении уровня окклюзии. Встроенный магнит фиксирует цветной колпачок на ручке установки окклюзии.
Составы кардиоплегических растворов
|
Компонент
|
Комплексный метод кардиопротекции | ||
|
первичная инфузия(раствор № 1) |
Повторная инфузия(раствор № 2) |
Реперфузия |
|
|
К+ (mmol/L) |
95,0 |
55,0 |
55,0 |
|
Na+ (mmol/L) |
131,0 |
131,0 |
131,0 |
|
Mg 2+(mmol/L) |
16,0 |
16,0 |
16,0 |
|
Ca2+ (mmol/L) |
2,0 |
2,0 |
2,0 |
|
Глюкоза (g/L) |
14,5 |
14,5 |
14,5 |
|
Трометамол (g/L) |
1,44 |
1,44 |
1,44 |
|
Изосорбид (mg/L) |
25,0 |
25,0 |
25,0 |
|
Неотон (mmol/L) |
— | — |
10,0 |
|
Лидокаин (mg/L) |
300,0 |
300,0 |
300,0 |
Обязательной является декомпрессия левого желудочка путем активного дренирования через правую верхнюю легочную вену с целью профилактики субэндокардиальной ишемии.
Методика контролируемой тепловой реперфузии миокарда. После выполнения основного этапа операции кардиоплегическая система заполняется оксигенированной кровью в сочетании с кардиоплегическим раствором № 2 в соотношении 4:1. В реперфузионном растворе должны быть достигнуты следующие параметры: гематокрит 23-25 %, содержание ионизированного калия 9-10 ммоль/л, pH 7,6-7,9. Реперфузионный раствор согревается до температуры 35-36 ° С и перед удалением зажима с аорты вводится в ее корень со скоростью 250 мл /мин. и двлении в корне аорты 80 мм рт. ст.
Оценка качества кардиопротекции. Уровень рН миокарда
 |
 |
 |
Вспомогательное кровообращение улучшение сократительной способности миокарда достигается двумя путями:
- снижая сопротивление выбросу, т.е. уменьшая постнагрузку — контрпульсация
- уменьшая объем наполнения желудочков, т.е. снижая преднагрузку — вено-артериальная перфузия, моно-, или бивентрикулярный обход
Внутриаортальная баллонная контрпульсация. Достижение разгрузочного эффекта (снижение постнагрузки) обеспечивается быстрым спадением баллона перед началом систолы левого желудочка. В результате наполнения баллона в фазу диастолы увеличивается давление в проксимальном отделе аорты, что увеличивает коронарное перфузионное давление и коронарный кровото
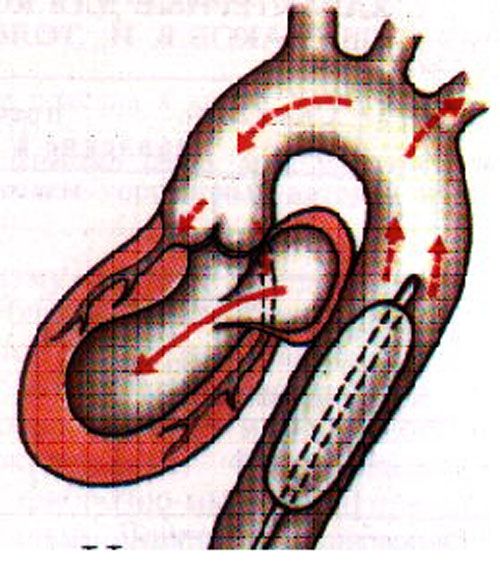 |
 |
Основным показанием к ВАБК является синдром «низкого» сердечного выброса, не поддающийся медикаментозной коррекции и проявляющийся снижением СИ .мин.м-2, АДср. 20 мм рт.ст. и ЦВД > 15 мм рт.ст. Длительность ВАБК зависит от стабилизации основных гемодинамических параметров. Максимальная длительность контрпульсации составляет 8 — 12 суток.Эффективность ВАБК во многом зависит от сроков ее начала. При остро развившейся сердечной недостаточности процесс нарастает настолько стремительно, что задержка с подключением ВАБК на 30 мин значительно снижает результативность последней. В этой связи и спользуется профилактическое применение контрпульсации у больных с высоким хирургическим риском.Показания к применению обхода ЛЖ такие же как и к ВАБК — интра- или послеоперационный синдром низкого сердечного выброса, инфаркт миокарда, сопровождающийся кардиогенным шоком.В настоящее время в РНПЦ используются устройства ВК как мост к выздоровлению, мост к решению, мост к трансплантации и терапия предназначения.Центробежный насос BIOPUMP для временной поддержки кровообращения как мост к выздоровлению или мост к решению.
 |
Система Thoratec (Thoratec Corp., Pleasanton, CA) экстракорпоральная система, которая используется для длительного или постоянного моно- и бивентрикулярного обхода, Ударный объем составляет 65 мл, производительность насоса 1,3-7,2 л\мин.
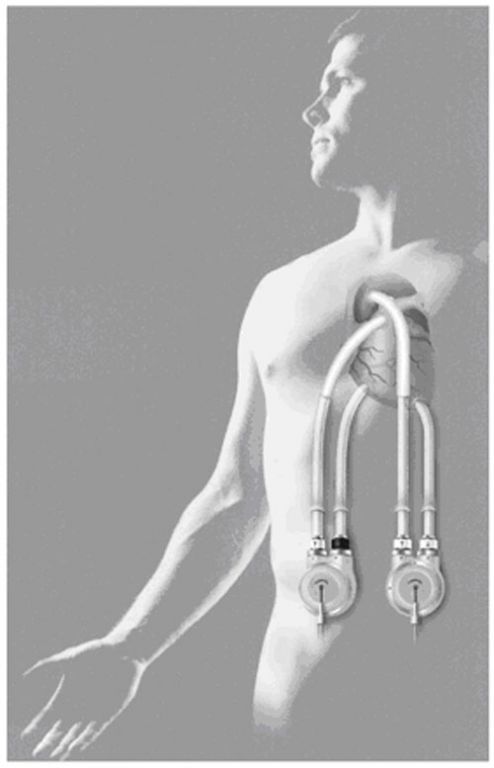 |
 |
Роторный насос HeartMate II (Thoratec Corp., Pleasanton, CA) производительность 10 л\мин. Используется для длительного или постоянного моновентрикулярного обхода.
 |
 |
Для профилактики тромбоэмболических осложнений используется варфарин (индекс Международного нормализованного отношения — МНО -2.5).
Определение «Искусственного кровообращения аппарат» по БСЭ:
Искусственного кровообращения аппарат (АИК)аппарат «искусственное сердце — легкие», аппарат, обеспечивающий оптимальный уровень кровообращения и обменных процессов в организме больного или в изолированном органе донора. предназначен для временного выполнения функций сердца и лёгких. На основании предшествующих многочисленных работ первый аппарат для искусственого кровообращения теплокровного организма, так называемый автожектор, был создан в 1925 советским учёным С. С. Брюхоненко при помощи этого аппарата советский учёный Н. Н. Теребинский в 1930 экспериментально доказал возможность успешной операции на клапанах сердца. В 1951 итальянские хирурги А. Дольотти и А. Костантини выполнили операцию удаления опухоли средостения, используя АИК. В СССР первую операцию на«сухом» сердце с помощью АИК осуществил в 1957 А. А. Вишневский. АИК включает комплекс взаимосвязанных систем и блоков: «искусственное сердце» — аппарат, состоящий из насоса, привода, передачи и нагнетающий кровь с необходимой для жизнеобеспечения объёмной скоростью кровотока.«искусственные лёгкие» — газообменное устройство, так называемый оксигенатор, служит для насыщения крови кислородом, удаления углекислого газа и поддержания кислотно-щелочного равновесия в физиологических пределах. Оксигенаторы в АИК могут быть сконструированы на основании одного из 4 принципов насыщения крови кислородом: пузырькового, плёночного, пенно-плёночного и через полупроницаемые синтетические мембраны. Модель пенно-плёночного оксигенатора была создана Брюхоненко и В. Д. Янковским в 1937. пенно-плёночный принцип применяется в основном в советских оксигенаторах, которые по своим функциональным качествам более физиологичны, чем работающие при прямом контакте дыхательных газов с кровью.Насосы для крови используют 3 типов: 1) создающие отдельно систолу и диастолу. основаны на принципе изменения объёма камеры мембраной при помощи гидравлической или пневматической среды. 2) создающие кровоток в гибких трубках расширением или сжатием. клапаны в этих насосах размещены в просвете трубки или вне её и 3) создающие кровоток прерывистой волной (роликовые и пальчиковые). Все насосы для крови по механизму действия разделяются на насосы с постоянным и переменным ударным объёмом, а по характеру создаваемого ими тока крови на насосы с малой и большой пульсацией. Для реализация температурных режимов, соответствующих цели операции, т. е. для проведении искусственного кровообращения в условиях нормальной или пониженной температуры, используют теплообменник с терморегулирующим устройством. Система управления обеспечивает заданные режимы работы как отдельных функциональных узлов, так и аппарата в целом. АИК приводят в действие при помощи гидравлического, пневматического или электромеханического приводов. При аварийном режиме применяют ручной привод.В мире создано более 100 типов различных по назначению АИК: для изолированной химиотерапии злокачественных новообразований, воспалительных процессов и деструктивных поражений. для так называемого вспомогательного искусственного кровообращения при тяжёлых нарушениях сердечной и дыхательной функции. для оживления больных и пострадавших, находящихся в состоянии клинической смерти. для поддержания жизнедеятельности изолированных органов, предназначенных для последующей пересадки, и т. д. Все аппараты имеют общую структурную схему (рис. 1) и отличаются друг от друга производительностью, особенностями систем управления или включения дополнительных специальных функциональных узлов. Схемы подключения АИК к сосудистой системе организма больного зависят от выбранного варианта искусственного кровообращения. Среди АИК для хирургии сердца распространёнными являются модели аппаратов, в которых«искусственное сердце» представлено роликовыми насосами, а «искусственные лёгкие» — дисковым оксигенатором . У советских аппаратов этого назначения АИК-5 (рис. 2), АИК-5М физиологический блок состоит из мембранных насосов и пенно-плёночного оксигенатора.Лит.: Галлетти П. М., Бричер Г. А., Основы и техника экстракорпорального кровообращения, пер. с англ., М., 1966.Н. А. Супер.Рис. 1. Блок-схема аппарата искусственного и кровообращения.Рис. 2. Аппарат искусственного кровообращения АИК-5 кардиохирургического назначения.

Оксигенатор
Существует два типа оксигенаторов: мембранные оксигенаторы (наиболее широко используемые) и пузырьковые оксигенаторы (в настоящее время практически не используются). Большинство оксигенаторов являются составной частью систем, в которые интегрированы теплообменник, венозный резервуар, артериальный фильтр, краны, коннекторы для магистралей и т.д. Мембранный оксигенатор может иметь или «истинную мембрану», которая полностью отделяет кровь от газов, и газы попадают в кровь путем диффузии (так же как это происходит в легких человека), или мембрану, которая содержит микропоры, через которые происходит перемещение молекул газа из/в кровь. Так как площадь поверхности «истинных мембран» для обеспечения адекватного газообмена достаточно большая, то в клинической практике наиболее распространено получило использование оксигенаторов на основе микропористых мембран. Существуют оксигенаторы с двумя принципиально важными дизайнами: 1 – кровь течет внутри или снаружи полых волокон; 2 – кровь и газ отделены друг от друга многократно сложенными пластинами из пористых мембран. Пузырьковые оксигенаторы состоят из двух камер. Поток венозной крови попадает в первую смешивающую камеру, где кровь перемешивается с потоком газа, что приводит к формированию огромного количества пузырьков, на поверхности которых и происходит процесс газообмена. После этого кровь попадает в камеру пеногашения, имеющую в своей конструкции пеногасящий элемент. Основным отличием пузырьковых оксигенаторов от мембранных является то, что:
первые несколько минут работы мембранного оксигенатора происходит активация процессов иммуновоспалительного ответа и системы комплемента, которая снижается после адгезии белков на поверхности мембран, в то время как в пузырьковом оксигенаторе процессы активации возникают в каждом новом пузырьке газа. Таким образом, для большей безопасности пациента и для длительных перфузий, предпочтительно использовать мембранные оксигенаторы
при использовании мембранных оксигенаторов имеет место больший перепад давления между насосом крови и артериальным фильтром
уровень вентиляции и оксигенации легче регулируется в мембранном оксигенаторе, чем в пузырьковом (изменением скорости потока газа и величиной процента кислорода в газовой смеси/FiO2).
Патологические процессы
Вспомогательное кровообращение приводит к тому, что организм пациента оказывается в беспрецедентных филогенетических условиях. Такие неадекватные процессы в организме, как резкое падение давления в сосудах и в сердечных отделах, ретроградный поток крови в аортальном сосуде, наличие в крови ее разрушенных тканей и элементов, выключение малого цикла кровоснабжения сердца приводят к патологическим реакциям больного на перфузию.
При операции с искусственным обращением крови нередко случается состояние, которое характерно для массивного повреждения тканей в совокупности с огромной потерей крови. Данное явление называется геморрагическим шоком. Обезболивание и анестезия не могут полностью избавить организм от чувствительности к влиянию перфузии, особенно к гуморальной составляющей.
Характерными явлениями считаются гемодинамические нарушения. Поскольку минутный объем кровообращения в процессе перфузии поддерживается функцией артериальных насосов, нарушения возникают из-за сдвигов в сосудистой системе.
 Операция на сердце
Операция на сердце
Искусственное сердце (ИС) и системы вспомогательного кровообращения
Системы вспомогательного кровообращения (СВК) – являются на сегодня одними из перспективных и интенсивно развивающихся направлений современной медицины. Обоснованием актуальности тем разработок является высокий уровень заболеваний с острыми формами сердечной патологии и недостаток донорских органов. Отсюда – интерес к созданию искусственного органа, частично/полностью заменяющего сердце в широком диапазоне его свойств и функций.
|
Если СВК дополняют собственное сердце пациента устройствами разгрузки левого и/или правого желудочка, то ИС полностью заменяет его механическим протезом. В этом главное и принципиальное отличие искусственного сердца от СВК. Соответственно, масштаб и сложность задач, решаемых при создании ИС, на порядок выше, чем при разработке СВК. Компания БИОСОФТ-М в течение 5 лет занимается созданием СВК совместно с ООО «ДОНА-М», институтом трансплантологии и МИЭТ. Основные задачи нашей компании – исследования, разработка и производство систем управления, диагностики, энергопитания и программно-алгоритмического обеспечения аппаратов частичной и полной замены сердца с использованием современных инновационных технологий. |
|
|
Накопленный опыт разработки источников автономного питания, управления, зарядки и программного обеспечения позволяет перейти к реализации СВК для бивентрикулярного обхода, насоса для педиатрии и имплантируемых систем искусственного сердца. В данной статье рассмотрены результаты разработки аппарата вспомогательного кровообращения носимого (АВК-Н) для левого желудочка сердца. Аппарат реализуется в имплантируемом варианте, прошёл все виды испытаний, сертифицирован и зарегистрирован в Министерстве здравоохранения России. |
Венозные канюли
Техника венозной канюляции описана здесь. Существует три основных типа венозных канюль: для канюляции полых вен (отдельная канюля для каждой полой вены), канюляции правого предсердия (двухуровневая канюля) и канюляции правого предсердия (канюля типа «Ross basket»). Канюля типа «Ross basket» представляет собой канюлю большого диаметра с металлическим наконечником, имеющим много боковых отверстий достаточно большого диаметра, предназначена для канюляции правого предсердия, фиксируется турникетом у края металлического наконечника. Двухуровневая канюля имеет коническую форму, как правило, корпус канюли усилен металлическим каркасом из проволоки для предотвращения перегиба корпуса канюли. Она устанавливается в правом предсердии, так чтобы ее носик находился в нижней полой вене, а проксимальное отверстие располагалось в полости правого предсердия (турникет фиксируется на уровне самого внешнего маркера канюли). Канюли для отдельной канюляции полых вен устанавливаются или прямо в полые вены (такие канюли, как правило, выбираются изогнутые под 90°, могут так же иметь изогнутый под 90° металлический носик), или через отдельные кисетные швы на правом предсердии (канюли могут быть как прямые, так и изгибаемые) проводятся в полые вены. Кроме того, канюли данного типа для избежания перегиба также могут иметь усиленный металлической проволокой корпус. Как правило, канюли установленные в верхнюю и нижнюю полые вены и обжимаются широкими турникетами (тесьмой) во время проведения искусственного кровообращения для полного дренажа крови пациента в контур ИК. Такое состояние может называться «полное искусственное кровообращение». Канюляция двухуровневой канюлей выполняется быстрее, может обеспечивать наилучшее дренирование крови из правых отделов сердца в определенных его положениях. При использовании бикавальной канюляции считается, что обеспечивается лучшее охлаждение миокарда, а значит, лучшая защита миокарда от ишемии, предотвращается попадание воздуха в венозную магистраль контура искусственного кровообращения. Этот метод широко используется при планируемом вскрытии «правых» отделов сердца или при вскрытии «левых» отделов и при наличии сообщения между «левыми» и «правыми» отделами (дефект междпредсердной перегородки, открытое овальное окно, дефект межжелудочковой перегородки). При использовании техники «полного ИК» предотвращается согревание миокарда, так как возврат венозной крови идет прямо в контур искусственного кровообращения. Использование канюляции типа «Ross basket» снижает риск повреждения нижней полой вены.
Примечания[править]
- Брюхоненко С.С., Чечулин С.И. Опыты по изолированию головы собаки (с демонстрацией прибора) // Труды II Всесоюзного съезда физиологов. — Л., 1926. — С. 289-290.
- Бакулев А.Н. Современные вопросы искусственного кровообращения в эксперименте и клинике. — М., 1966. — С 5.
- Андреев С.В., Косарев И.Н. Центральные научно-исследовательские лаборатории медицинских вузов СССР. — М., 1971. — С. 41.
- С.С. Брюхоненко и С.И. Чечулин — рождение искусственного кровообращения. // Новости медицины и фармации, 10 (365), 2011
- ↑
- Уткин В. В. Завод у двуречья. 1973—1992 (часть 1). — Кирово-Чепецк: ОАО «Кирово-Чепецкий химический комбинат им. Б. П. Константинова», 2007. — 144 с. — 1000 экз. — ISBN 978-5-85271-293-6.
Проведение искусственного кровообращения
Проведение искусственного кровообращения начинают с одновременного включения артериального насоса и снятия зажимов с венозной линии аппарата, не допуская полного оттока крови из организма. Синхронно увеличивая производительность насоса и величину венозного притока, доводят объёмную скорость перфузии до расчётной (2,2—2,4 л/мин на 1 м² поверхности тела). В дальнейшем руководствуются критериями адекватности перфузии.
Длительность искусственного кровообращения зависит от характера патологии и колеблется от нескольких минут (ушивание дефекта межпредсердной перегородки, ликвидация изолированного клапанного стеноза лёгочного ствола) до многих часов (одновременное протезирование нескольких клапанов сердца).
Переход на естественное кровообращение начинают с постепенного или одномоментного прекращения поступления крови в аппарат с одновременным уменьшением производительности артериального насоса. Нагнетание крови в артерии полностью прекращают по достижении оптимального объёма циркулирующей крови в сосудистом русле больного, о чём судят по величине центрального венозного давления, которая должна составлять в этот момент 150—180 мм водного столба.
В случае длительного искусственного кровообращения (свыше 1 часа) целесообразно сочетать его с искусственной гипотермией, которая сопровождается снижением потребности организма в кислороде, что позволяет уменьшить объёмную скорость перфузии, а тем самым и травму . В большинстве случаев достаточна умеренная гипотермия (температура в пищеводе не ниже 28°). Глубокая гипотермия до 15—10° применяется крайне редко, при необходимости временной полной остановки кровообращения.
При проведении искусственного кровообращения широко применяют метод управляемой гемодилюции, то есть разбавления циркулирующей крови замещающими жидкостями (например, низкомолекулярными растворами электролитов, сахаров или белков).