Почему так важно соблюдать рн-баланс кожи
Содержание:
- Соблюдайте правильный рН баланс для сохранения крепкого здоровья
- От чего зависит PH крови?
- Что такое pH
- Что означает pH?[править | править код]
- Тестирование уровня pH кислотно-щелочного баланса
- Основная разница — рН против кислотности
- Значение уровня ph для водопроводной воды и других сред
- Незнание уровня своего рН может привести к печальным последствиям
- Кислотно-щелочной баланс и здоровье
- Что такое ЕС (PPM)
- Результаты
- Роль pH в химии и биологии[править]
- Алкалоз и его причины
- Роль pH в химии и биологии
- Определение кислотности в домашних условиях
- Комментарии[править]
- Причины резкого снижения: ацидоз
- Значения pH в растворах различной кислотности
Соблюдайте правильный рН баланс для сохранения крепкого здоровья
Организм способен правильно усваивать и накапливать минералы и питательные вещества только при надлежащем уровне кислотно-щелочного равновесия. В ваших силах помочь своему организму получать, а не терять полезные вещества. Например, железо может усваиваться организмом при рН 6,0-7,0, а йод — при рН 6,3-6,6. Наш организм использует соляную кислоту для расщепления пищи. В процессе жизнедеятельности организма требуются как кислые, так и щелочные продукты распада, причем первых образуется в 20 раз больше, нежели вторых. Поэтому защитные системы организма, обеспечивающие неизменность его КЩР, «настроены» прежде всего на нейтрализацию и выведение прежде всего кислых продуктов распада.
Основными механизмами поддержания этого равновесия являются: буферные системы крови (карбонатная, фосфатная, белковая, гемоглобиновая), респираторная (легочная) система регуляции, почечная (выделительная система.
В Ваших интересах поддерживать правильный рН-баланс.
Даже «самая правильная» программа по подбору лечебных трав не будет эффективно работать, если ваш рН-баланс нарушен.
|
Как организм управляет уровнем кислотности
|
От чего зависит PH крови?
От чего зависит PH крови?
Если уровень PH становится слишком низким — менее 7,35 (кислым) или слишком высоким — более 7,45-8 (щелочным), то клетки нашего организма начинают отравлять сами себя токсичными выбросами и погибают. Появляются шлаки и токсины в большом количестве. В этом случае многие люди начинают выводить эти вредные вещества из организма. Но нужно просто привести в норму показатели PH крови, мочи и слюны. От чего зависит PH крови?
Этот показатель зависит от следующих факторов:
- Питания — нужно научиться азам правильного питания. В нашем организме должен быть соблюден баланс белков, жиров и углеводов.
- Стрессоустойчивости — постоянное нервное напряжение приводит к закислению организма. Научитесь быть спокойными и не нервничать по пустякам.
- Ожирение — когда организм закислен, он начинает накапливать жир. Если производить ощелачивание, то вы сразу начнете худеть, а значит, улучшится самочувствие, состояние кожи и волос.
Кислотно-щелочной баланс в организме зависит от сохранения правильных пропорций между межклеточными и внутриклеточными водами в тканях. Если кислотно-щелочное равновесие жидкостей не будет соблюдаться постоянно, окажется невозможным сохранение жизни и нормальное функционирование всех органов и систем.
От чего зависит PH?
Что такое pH
Как горячий и холодный — две крайности, описывающие температуру, также есть две крайности, которые описывают все химические вещества. Это кислота и щелочь.
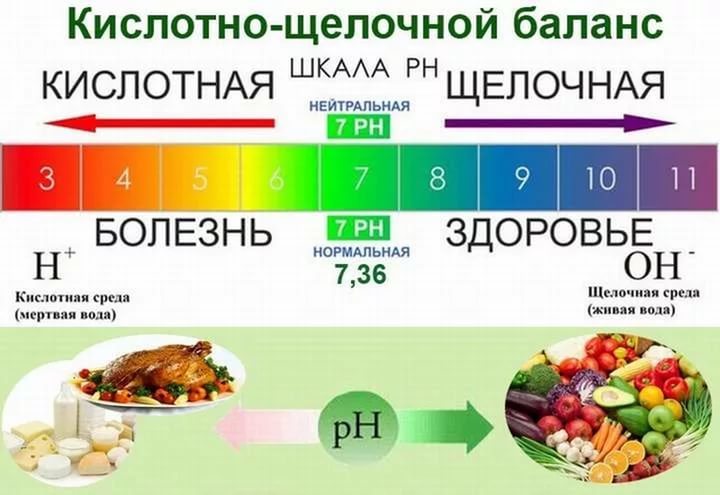
pH — это показатель соотношения щелочи и кислоты.
Смешивание кислоты и щелочи «обнуляет» их свойства. Так же как смешивание горячей и холодной воды выравнивает ее температуру. Нейтральное вещество не является ни кислотой, ни щелочью.
Для определения рН существует шкала — от 0 до 14. Именно она показывает насколько вещество является кислотным или щелочным.
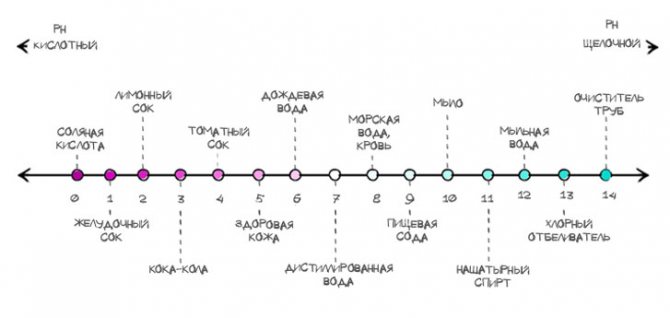
Нейтральный рH равен 7 (это рH чистой воды). рH от 0 до 6,9 указывает на кислотную среду. рH от 7,1 до 14 определяет щелочную среду.
Запомните — чем ниже рН, тем он более кислотный, чем выше pH, тем он более щелочной.
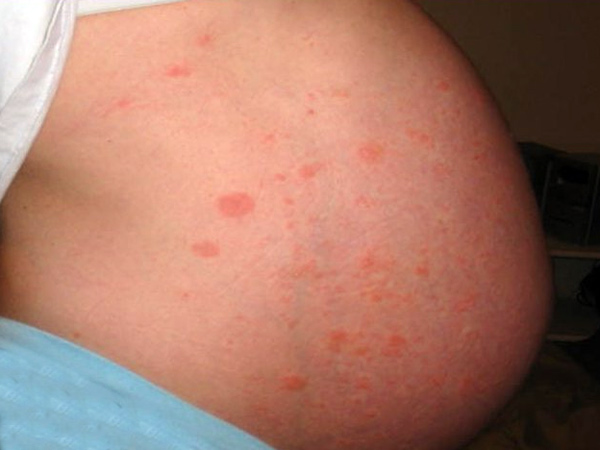
Сильно кислые вещества (например, лимонный сок) и сильно щелочные (например, отбеливатель) могут вызвать серьёзные повреждения кожи.
Безопасный для кожи человека диапазон pН — от 3 до 9. Вещества с pН выше и ниже этих значений могут вызвать покраснение, раздражение и даже химический ожог
Это важно знать для правильного выбора и применения косметических средств
Что означает pH?[править | править код]
pH — это водородный показатель раствора (Power of Hydrogen). Величина pH, по определению, равна отрицательному десятичному логарифму концентрации ионов водорода. У читателей может возникнуть вопрос, зачем вообще понадобилось вводить новое понятие, не проще ли выражать концентрацию ионов водорода в обычных единицах. Дело в том, что понятие pH было введено химиками. Оказалось, что при проведении химических опытов значительно удобнее выражать концентрацию ионов водорода через водородный показатель. В клинической практике мы измеряем pH артериальной крови, который варьирует незначительно — от 6,9 до 7,9, но химики имеют дело со всем спектром возможных значений pH, от 1 до 14. Если бы мы выражали концентрацию ионов водорода в обычных единицах (моль/л), вычисления оказались бы слишком громоздкими. Таким образом, использование pH значительно облегчает и сокращает расчеты. В таблице показаны нормальные значения pH крови и крайние значения, которые наблюдаются при патологических состояниях, сопровождающихся развитием ацидоза или алкалоза.
Шкала pH — не линейная!править | править код
Выражение «pH крови пациента изменился на 0,3 единицы» означает, что концентрация ионов водорода повысилась (или понизилась) вдвое.
Когда мы слышим, что «pH артериальной крови пациента повысился/понизился на 0,2», мы можем недооценить истинное изменение концентрации ионов водорода. Всегда нужно помнить: значение pH — это логарифм. Так, если pH артериальной крови снизился с 7,20 до 7,00, это означает, что концентрация ионов водорода изменилась на 37 нмоль/л, а падение значения pH с 7,00 до 6,80 соответствует повышению на 60 нмоль/л.
Десятичный логарифм числа 2 равен 0,3 (2=100,3). Поэтому если pH падает на 0,3 единицы, например, с 7,40 до 7,10, это значит, что концентрация ионов Н+ повысилась вдвое (с 40 до 80 нмоль/л). Соответственно повышение pH с 7,40 до 7,70 отражает понижение концентрации ионов Н+ с 40 до 20 нмоль/л.
Что такое pHправить | править код
Почему же многие учащиеся не могут разобраться в теории кислот и оснований?
Это происходит из-за злоупотребления сложившимся «псевдонаучным жаргоном». Часто теорию кислот и оснований считают трудной темой. В этой теории рассматривается понятие кислоты как вещества, способного диссоциировать на анион кислотного остатка (сопряженное основание) и на ион водорода (протон). Еще в 1962 г. Криз (Creese) с соавторами в своей статье в журнале «Ланцет» (Lancet) писали, что «в медицинской литературе, посвященной этой теме, авторы злоупотребляют псевдонаучным жаргоном, что только сбивает читателей с толку».
Трудности возникают из-за традиционной номенклатуры, которую проиллюстрируем таким диалогом:

Тестирование уровня pH кислотно-щелочного баланса
Вот так можно проверить свой собственный уровень рН
- Вы можете проверить свой pH, купив специальные индикаторные полоски в местном магазине здоровой пищи или аптеке.
- Измерение pH можно проводить по слюне или моче. Второе утреннее мочеиспускание даёт лучшие по точности результаты pH.
- Вы сравниваете цвета на тест-полоске с диаграммой масштаба pH, которая поставляется вместе с этим комплектом тест-полосок.
- В течение дня лучшее время для проверки pH — один час до еды и два часа после еды.
- Если вы тестируете свою слюну, то идеальный для здоровья диапазон pH между 6,8 и 7,3 (помните, что оптимальный pH составляет около 7,365).
Рекомендуем прочесть нашу книгу:
Диагноз – рак: лечиться или жить? Альтернативный взгляд на онкологию
Чтобы максимально быстро войти в тему альтернативной медицины, а также узнать всю правду о раке и традиционной онкологии, рекомендуем бесплатно почитать на нашем сайте книгу «Диагноз – рак: лечиться или жить. Альтернативный взгляд на онкологию»
Читать бесплатно
Основная разница — рН против кислотности
pH и кислотность являются родственными терминами, которые объясняют друг друга. Кислотность — это количество ионов гидрония, присутствующих в растворе. pH — это шкала, используемая для измерения количества ионов гидрония, присутствующих в растворе. Следовательно, pH может количественно определить кислотность системы. Эти термины часто используются в водной химии, которая объясняет поведение и свойства водных объектов. Основное различие между pH и кислотностью заключается в том, что pH — это количественное измерение кислотности или основности раствора в то время как кислотность — это качественное измерение кислотных свойств раствора.
Ключевые области покрыты
1. Что такое рН — Определение, Значения, Свойства2. Что такое кислотность — определение, свойства3. Какова связь между pH и кислотностью? — Краткое описание общих черт 4. В чем разница между pH и кислотностью — Сравнение основных различий
Ключевые термины: Константа диссоциации кислоты, Кислотность, Основность, Ион гидроксония, Лакмус, Монопротон, рН, Сильные кислоты, Слабые кислоты.

Значение уровня ph для водопроводной воды и других сред
Уровень рН для водопроводной воды, также имеет большое
значение, и поэтому важно следить за ним. Если pH питьевой водопроводной воды
ниже 6,5, то высока вероятность попадания в нее меди
Высокий уровень меди
может привести к повреждению печени, особенно у детей и младенцев. Кроме того,
легионеллы особенно хорошо растут в кислотной среде, и тяжелый металл лучшее
растворяются в кислых растворах.
Такая вода имеет неприятный кислый вкус, металлический
привкус. Она может окрашивать стоки, раковины и даже белье в ржавый цвет, стать
причиной преждевременного выхода из строя стиральных, посудомоечных машин.
Водопроводная вода с рН выше 8,5 считается «жесткой». Такая
вода не опасна для здоровья, но может стать причиной образования осадка в
трубах и бытовых приборах. Она имеет щелочной привкус, что ухудшает вкус кофе и
чая. Если рн водопроводной воды становится выше 11, то она становится мылкой и
может вызывать раздражения кожи.
Показатель рН важен не только для воды, но и для других
биологических сред, особенно это касается биохимических реакций живых систем.
Например, норма рН для крови человека составляет 7,34-7,4. При падении его до
6,95 человек может потерять сознание, а увеличение рН=7,7 может стать причиной
сильных судорог.
Незнание уровня своего рН может привести к печальным последствиям
А) Повышенная кислотность в организме.
Дисбаланс рН организма у большинства людей проявляется в виде повышенной кислотности (состояние Ацидоз). В этом состоянии организм плохо усваивает минералы, такие как кальций, натрий, калий и магний, которые, благодаря избыточной кислотности, выводятся из организма. От недостатка минералов страдают жизненно важные органы. Не выявленный вовремя ацидоз может вредить организму незаметно, но постоянно в течение нескольких месяцев и даже лет. Злоупотребление алкоголем часто приводит к ацидозу. Ацидоз может возникать, как осложнение диабета.
При Ацидозе могут появиться следующие проблемы:
- Заболевания сердечно-сосудистой системы, включая стойкий спазм сосудов и уменьшение концентрации кислорода в крови.
- Прибавление в весе и диабет.
- Заболевания почек и мочевого пузыря, образование камней.
- Снижение иммунитета.
- Увеличение вредного воздействия свободных радикалов, которые могут способствовать онкогенезу.
- Хрупкость костей вплоть, до перелома шейки бедра, а также других нарушениях опорно-двигательного аппарата, как например, образование остеофитов (шпор).
- Появление суставных болей и болевых ощущений в мышцах, связанных с накоплением молочной кислоты.
- Общая слабость.
Б) Повышенное содержание щёлочи в организме.
При повышенном содержании щелочи в организме, а это состояние называется Алкалоз, также как при ацидозе, нарушается усвоение минералов. Пища усваивается гораздо медленнее, что позволяет токсинам проникать из желудочно-кишечного тракта в кровь. Повышенное содержание щелочи в организме опасно и трудно поддается корректировке. Как правило, оно является результатом употребления лекарств, содержащих щелочь.
Повышенное содержание щелочи может спровоцировать:
- Проблемы с кожей и печенью.
- Сильный и неприятный запах изо рта и тела.
- Активизацию жизнедеятельности паразитов.
- Разнообразные аллергические проявления, в том числе связанные с пищей и загрязнением окружающей среды.
- Обострение хронических заболеваний.
- Запоры и другие проблемы с кишечником.
Кислотно-щелочной баланс и здоровье

Всю еду, входящую в рацион, можно условно разделить на щелочную и кислотную. Из количества её потребления складывается кислотно-щелочной баланс организма. Его показатель обозначается – pH. Оптимальный для здоровья уровень варьируется от 7,36 до 7,44. Эта цифра верна для определения pH крови. Каждый орган в отдельности имеет своё значение кислотно-щелочного баланса, которое является для него нормой.

При смещении рН в одну из сторон возникают нарушения в работе организма. Чаще всего сдвиг происходит в сторону кислотной среды, так как в рационе преобладают именно «кислые» продукты. Для их нейтрализации необходима щелочь, запас которой есть у организма. Но он не бесконечен и требует постоянного пополнения. Для этого необходимо отрегулировать своё питание так, чтобы в нём присутствовало только 20% кислотных продуктов, а щелочных – 80%.
Что такое ЕС (PPM)
С кислотностью разобрались, теперь узнаем подробнее о солености субстрата (раствора) или его уровне минерализации. Как понятно из названия, этот показатель рассказывает нам об общем количестве (концентрации) растворенных солей в измеряемой жидкости (TDS – Total Dissolved Solids).
Измеряется это общее солесодержание TDS в разных единицах – ЕС или PPM (это просто разные шкалы измерения одного и того же, как градусы Цельсия и градусы Фаренгейта для измерения температуры, к примеру). PPM – единица минерализации (количество частиц солей, растворенных в 1 миллионе частиц воды), ЕС – электропроводимость (измеряется в миллисименсах на см, мС/см, если вам действительно интересно). Используют ту шкалу, которая удобнее – существуют таблицы перевода одной в другую, где 70 PPM = 0,1 ЕС.
За рубежом существуют и другие системы перевода этих значений, с иными числами – не запутайтесь при пересчете!
Так, полностью очищенная от всех солей дистиллированная вода имеет PPM в районе 0 (и электропроводимость, ЕС, такую же, т.е. не проводит электричество). Добавки любого растворенного в ней вещества (соли) повышают значение TDS. При этом каждое вещество, разумеется, делает это в разной степени – например, натрий (Na), калий (K) и кальций (Ca) сильно поднимают уровень минерализации, а железо (Fe) или Mn (марганец) – в гораздо меньшей степени. Так, чистейшая питьевая вода из родника уже может иметь до 100 единиц PPM (или до 0,15 ЕС), непригодные для питья значения стартуют от 300 (0,45 ЕС), опасные для здоровья – от 500 (0,75 ЕС).
Что это значит для растений? Показатели TDS крайне важны для растворов удобрений. Чем выше электропроводимость раствора, тем выше концентрация солей в нем и тем труднее растениям его впитывать.
Рекомендации по электропроводности раствора (мС/см) составляют для:
- черенков – 0,2-0,4 ЕС;
- молодых укоренившихся растений – 0,8-1,2 ЕС;
- вегетирующих растений – 1,6-1,8 ЕС;
- цветущих и плодоносящих растений – 1,8-2,2 ЕС.
Как измеряют EC (РРМ) растворов и воды для контроля уровня солей и минералов, анализа жесткости, электропроводности? Разумеется, ТDS-метром (иначе, кондуктометром), который также можно приобрести в специализированном садоводческом или хозяйственном магазине. Обычно качество воды в таких приборах для удобства пользователя измеряется и в значениях PPM, и в ЕС.
Как видите, страшные и непонятные физико-химические термины при ближайшем рассмотрении оказываются не такими уж ужасными, а вполне себе понятными и, главное, полезными для любого огородника. Помогите своим растениям действительно усвоить все питательные вещества, которые вы им предлагаете, и они не преминут ответить дружным урожаем.
Результаты
После завершения исследования гастроэнтеролог снимает показания, зафиксированные специальным приемником.
Результаты могут быть следующими:
- 7,0-7,5 – анацидность.
- 3,6-6,9 – выраженная степень гипоацидности.
- 2,3-3,5 – пониженная кислотность.
- 1,6-2,2 – норма.
- 1,3-1,5 — умеренная степень гиперацидности.
- 0,9-1,2 — выраженная степень гиперацидности.
Следует отметить, что гастроэнтеролог учитывает не только полученные цифровые показатели, но и общее состояние желудка. К примеру, уровень кислотности для пациента, страдающего от язвы, будет избыточным.
В случае, когда у пациента обнаруживается снижение кислотности, ему рекомендуют пройти суточное мониторирование. Подобная методика позволяет исключить получение ложных результатов, которые нередко встречаются, если пациент накануне исследования не отказался от препаратов, способных угнетать секрецию желудочного сока.

Суточное мониторирование редко показывает истинную гипоацидность. О ее наличии можно судить лишь в том случае, если показатели кислотности не опускались ниже 4,0 на протяжении всего исследования. В подобном случае делается вывод, что соляная кислота в желудке пациента не вырабатывается, а пищеварение отсутствует.
Роль pH в химии и биологии[править]
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.. Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах
Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
Алкалоз и его причины
Алкалоз, или защелачивание крови, — заболевание, встречающееся нечасто и возникающее из-за большой потери кислоты в организме или по причине накопления щелочи. Значительное снижение кислоты возможно из-за частой и длительной рвоты (например, при отравлении) либо нарушения отдельных функций почек, ответственных за регуляцию кислотного равновесия.
Выделяют два типа алкалоза:
- газовый, который развивается из-за повышенной отдачи легкими углекислого газа (гипервентиляция, постоянное нахождение на большой высоте – высотная болезнь);
- не газовый, который возникает при высоких щелочных резервах (поступлении большого количества щелочи с пищей, нарушение обмена веществ).
Основные причины, приводящие к снижению кислоты:
- излишнее употребление пищи с большим содержанием щелочи (это зеленый чай, молоко и продукты на его основе);
- излишний вес, переходящий в ожирение;
- наличие сердечно-сосудистых болезней;
- нервный срыв, эмоциональное перенапряжение;
- прием некоторых лекарственных препаратов, приводящих к сбою щелочного равновесия.
Роль pH в химии и биологии
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.. Водородный показатель pH широко используется для характеристики кислотно-осно́вных свойств различных биологических сред.
Водородный показатель pH широко используется для характеристики кислотно-осно́вных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах
Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-осно́вного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
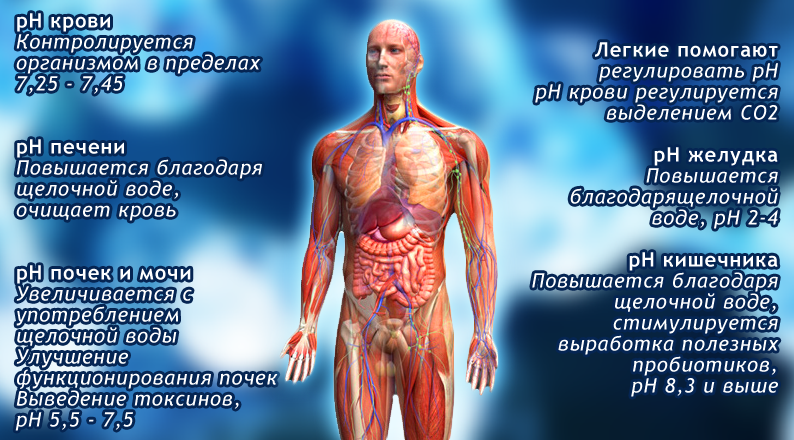
В человеческом организме в различных органах водородный показатель различен. Нормальный рН крови составляет 7,36, то есть кровь имеет слабоосновную реакцию (с колебаниями от 7,34 у венозной крови до 7,40 у артериальной). В зависимости от биохимических изменений в крови может наблюдаться ацидоз (увеличение кислотности) или алкалоз (увеличение осно́вности), однако совместимый с жизнью диапазон pH крови невелик, поскольку уже при уменьшении pH до 6,95 наступает потеря сознания, а смещение реакции крови в щелочную сторону до pH = 7,7 вызывает тяжелейшие судороги. Поддержание кислотно-основного баланса крови в допустимых пределах осуществляется буферными системами крови, главной из которых является гемоглобиновая. Нормальный водородный показатель желудочного сока (в просвете тела желудка натощак) равен 1,5…2,0. У сока тонкой кишки pH в норме составляет 7,2…7,5, при усилении секреции достигает 8,6. pH содержимого толстого кишечника может варьировать в норме от 6,0 до 7,2 единиц и зависит прежде всего от уровня продукции жирных кислот его микробиотой.
Определение кислотности в домашних условиях
Нередко люди, имеющие какие-либо заболевания, интересуются возможностью узнать кислотность крови самостоятельно, не обращаясь в поликлинику
Важно знать, как проверить ее правильно
Благодаря наличию в аптечной сети специальных портативных приборов и тест-полосок, у каждого имеется возможность узнать кислотно-щелочное равновесие крови самостоятельно в домашних условиях.
При определении уровня pH прибор для измерения прикладывается к пальцу, тончайшей иглой производится прокол для забора нескольких капель крови. Внутри аппарата находится микрокомпьютер, в котором рассчитываются значения, и конечный результат отображается на экране. Процедура занимает минимум времени и проходит безболезненно.
Для того чтобы определить Ph дома, можно использовать и тест-полоски. Также необходимо приобрести скарификаторы для прокола пальца и соблюсти несложные рекомендации:
- проколоть палец;
- выдавить каплю крови в емкость или медицинскую пробирку, что предпочтительнее;
- опустить в кровь тест-полоску, оставить там на несколько секунд.
Полученный результат следует сравнить со шкалой, нанесенной на упаковку, выбрать подходящий цвет и определить у себя норму или отклонение показателя.
Измерить кислотность прибором значительно проще, так как вся процедура происходит автоматически: прокол, забор крови, выдача результата.
Комментарии[править]
Об источникеправить
В 1965 г. Роджер Бейтс пишет проф. Б. П. Никольскому и проф. М. М. Шульцу:
Профессор Р. Г. Бейтс, Департамент электрохимических исследований, Национальное бюро стандартов, Вашингтон, США, 8 марта, 1965 г. СССР, Ленинград, Ленинградский Государственный Университет,
проф. Б. П. Никольскому, проф. М. М. Шульцу
Глубокоуважаемые профессора Никольский и Шульц!
Занимаясь стандартизацией измерений pH, я смог по достоинству оценить ваши превосходные работы по стеклянному электроду, которые значительно расширили понимание механизма действия иона водорода. Я надеюсь в скором времени получить возможность побывать в вашей стране в связи с Московским конгрессом Международного союза общей и прикладной химии. Я был бы очень признателен вам, если бы смог посетить ваш институт и познакомиться с вами.
Предполагая, что сессия конгресса закончится 18 июля, я надеюсь быть в Ленинграде 19 июля. Возможно ли моё посещение Вашего института 20 или 21 июля? Я хорошо знаком также с некоторыми работами доктора Л. Л. Макарова и, если это удобно, хотел бы встретиться и с ним.
С наилучшими пожеланиями искренне Ваш Роджер Г.Бейтс,
руководитель отдела электрохимического анализа Национального бюро стандартов.
(Архив академика М. М. Шульца)
В 1968 г. было осуществлено первое издание книги Р.Бейтса на русском языке (под редакцией проф. Б. П. Никольского и проф. М. М. Шульца): Determination of pH. Roger G. Bates, National Bureau of Standards. John Wiley & Sons Inc. New York — London — Sydney. 1964
Причины резкого снижения: ацидоз
Резкое снижение уровня кислотно-щелочного баланса в организме получило название ацидоз. Это состояние встречается довольно часто, что обусловлено высокой подверженностью органов и систем к защелачиванию. Основным провоцирующим фактором в формировании ацидоза выступает чрезмерное потребление алкогольной продукции. Появление «кислой» крови нередко обусловлено осложнениями, вызванными стремительно протекающим сахарным диабетом.
Если отклонения от нормы незначительные, человек не догадывается о наличии проблемы. Яркая клиническая картина возникает при остром ацидозе. Для этого состояния характерны следующие симптомы: постоянная тошнота, изжога, рвотные позывы, нарушение дыхательной функции, упадок сил.
 Значение нормы
Значение нормы
Ацидоз приводит к нарушению обменных процессов в организме, ткани и клетки не получают необходимого количества кислорода. Отсутствие питания сопровождается снижением уровня микроэлементов (Кальция, Магния, Калия и Натрия) в организме, что характерно для следующих состояний:
- доброкачественных и злокачественных новообразований;
- патологий со стороны мочевыводящей системы;
- заболеваний сердца и сосудов;
- мышечной боли;
- чрезмерной массы тела;
- ломкости и хрупкости костной ткани;
- нарушения защитных функций организма.
Важно: измерение PH крови осуществляется в лабораторных условиях, после заборе биологического материала. Выявить истинную причину отклонений способен лечащий врач на основании результатов проведенных анализов
Выявить истинную причину отклонений способен лечащий врач на основании результатов проведенных анализов.
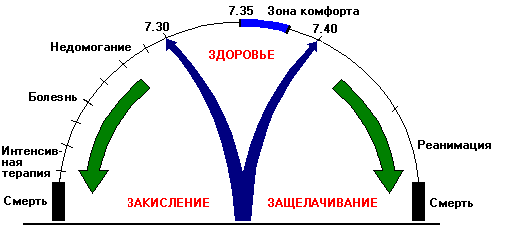 Зона комфорта
Зона комфорта
Значения pH в растворах различной кислотности
|
Так как при 25 °C (стандартных условиях) · = 10−14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислотных растворах > 10−7, то у кислотных растворов pH 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH +, так и OH−); при понижении температуры, напротив, нейтральная pH возрастает.